Todas as coisas existentes na natureza são constituídas de átomos ou suas combinações.
Atualmente, sabemos que o átomo é a menor estrutura da matéria que apresenta as propriedades
de um elemento químico.
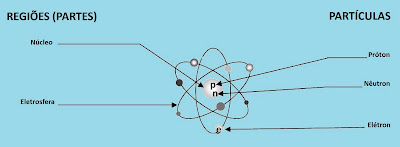
A estrutura de um átomo é semelhante à do Sistema Solar, consistindo em um núcleo,
onde fica concentrada a massa, como o Sol, e em partículas girando em seu redor, denominadas
elétrons, equivalentes aos planetas.
Como o Sistema Solar, o átomo possui grandes espaços vazios, que podem ser atravessados
por partículas menores do que ele.
A comparação com o sistema solar, embora sirva para dar uma idéia visual da estrutura do
átomo, destacando os “grandes espaços vazios”, não exprime a realidade.
No sistema solar, os planetas se distribuem quase todos num mesmo plano de rotação ao
redor do Sol. No átomo, os elétrons se distribuem em vários planos em torno do núcleo. Não é
possível determinar simultaneamente a posição de um elétron e sua velocidade num dado instante.
A ESTRUTURA DA MATÉRIA E O ÁTOMO
ESTRUTURA DO NÚCLEO
O núcleo do átomo é formado, basicamente, por partículas de carga positiva, chamadas
prótons, e de partículas de mesmo tamanho mas sem carga, denominadas nêutrons.
O número de prótons (ou número atômico) identifica um elemento químico, comandando
seu comportamento em relação aos outros elementos.
O elemento natural mais simples, o hidrogênio, possui apenas um próton; o mais complexo,
o urânio, tem 92 prótons, sendo o elemento químico natural mais pesado.

Os núcleos instáveis de uma mesma espécie (mesmo elemento químico) e de massas
diferentes, denominados radioisótopos, não realizam todas as mudanças ao mesmo
tempo.
OS ISÓTOPOS
O número de nêutrons no núcleo pode ser variável, pois eles não têm carga elétrica. Com
isso, um mesmo elemento químico pode ter massas diferentes. Átomos de um mesmo
elemento químico com massas diferentes são denominados isótopos.
O hidrogênio tem 3 isótopos: o hidrogênio, o deutério e o trítio.
- • U-234, com 142 nêutrons (em quantidade desprezível);
- • U-235, com 143 nêutrons, usado em reatores PWR, após enriquecido (0,7%);
- • U-238, com 146 nêutrons no núcleo (99,3%).
RADIOATIVIDADE
O esquecimento de uma rocha de urânio sobre um filme fotográfico virgem levou à descoberta
de um fenômeno interessante: o filme foi velado (marcado) por “alguma coisa”que saía da rocha, na época denominada raios ou radiações.
Outros elementos pesados, com massas próximas à do urânio, como o rádio e o polônio,
também tinham a mesma propriedade.
O fenômeno foi denominado radioatividade e os elementos que apresentavam essa
propriedade foram chamados de elementos radioativos.
Comprovou-se que um núcleo muito energético, por ter excesso de partículas ou de
carga, tende a estabilizar-se, emitindo algumas partículas.
As emissões de radiação são feitas de modo imprevisto e não se pode adivinhar o momento
em que um determinado núcleo irá emitir radiação.
Entretanto, para a grande quantidade de átomos existente em uma amostra é razoável
esperar-se um certo número de emissões ou transformações em cada segundo. Essa
“taxa” de transformações é denominada atividade da amostra.
UNIDADE DE ATIVIDADE
A atividade de uma amostra com átomos radioativos é medida em:
Bq (Becquerel) = uma desintegração por segundo
Ci (Curie) = 3,7 x 1010 Bq
DESINTEGRAÇÃO OU TRAMUTAÇÃO RADIOATIVA
Como foi visto, um núcleo com excesso de energia tende a estabilizar-se,
emitindo partículas alfa ou beta.
Em cada emissão de uma dessas partículas, há uma variação do número de prótons no
núcleo, isto é, o elemento se transforma ou se transmuta em outro, de comportamento
químico diferente.
Essa transmutação também é conhecida como desintegração radioativa, designação
não muito adequada, porque dá a idéia de desagregação total do átomo e não apenas da
perda de sua integridade. Um termo mais apropriado é decaimento radioativo, que sugere
a diminuição gradual de massa e atividade.
Cada elemento radioativo, seja natural ou obtido artificialmente, se transmuta (se desintegra
ou decai) a uma velocidade que lhe é característica.
Para se acompanhar a duração (ou a “vida”) de um elemento radioativo foi preciso
estabelecer uma forma de comparação.
Por exemplo, quanto tempo leva para um elemento radioativo ter sua atividade reduzida
à metade da atividade inicial ? Esse tempo foi denominado meia-vida do elemento
Meia-vida, portanto, é o tempo necessário para a atividade de um
elemento radioativo ser reduzida à metade da atividade inicial.
Isso significa que, para cada meia-vida que passa, a atividade vai sendo reduzida à
metade da anterior, até atingir um valor insignificante, que não permite mais
distinguir suas radiações das do meio ambiente. Dependendo do valor inicial, em muitas
fontes radioativas utilizadas em laboratórios de análise e pesquisa, após 10 (dez) meiasvidas,
atinge-se esse nível. Entretanto, não se pode confiar totalmente nessa “receita” e
sim numa medida com um detector apropriado, pois, nas fontes usadas na indústria e na
medicina, mesmo após 10 meias-vidas, a atividade da fonte ainda é geralmente muito
alta.
Exemplo facil
Um exemplo “caseiro” pode apresentar, de forma simples, o conceito de meia-vida: uma família de 4 pessoas
tinha 4 kg de açúcar para seu consumo normal. Logicamente, a função do açúcar é adoçar o café, o
refresco, bolos e sucos. Adoçar é a atividade do açúcar, assim como a emissão de radiação
é a atividade dos elementos radioativos.
Por haver falta de açúcar no supermercado, foi preciso
fazer um racionamento, até a situação ser normalizada,
da seguinte forma: na primeira semana, foram consumidos
2 kg, metade da quantidade inicial, e “conseguiu-se” fazer dois bolos, um pudim, refrescos, sucos, além de
adoçar o café da manhã. Na segunda semana, foi consumido 1 kg, metade da quantidade anterior e ¼ da
inicial. Aí, já não deu para fazer os bolos.
Na terceira semana, só foi possível adoçar os refrescos, sucos e café, com os 500 gramas então existentes.
Procedendo da mesma forma, na décima semana restaram cerca de 4 g de açúcar, que não dariam para
adoçar um cafezinho. Essa quantidade de açúcar não
faria mais o efeito de adoçar e nem seria percebida.
No exemplo citado, a meia-vida do açúcar é de uma
semana e, decorridas 10 semanas, praticamente não
haveria mais açúcar, ou melhor, a atividade adoçante
do açúcar não seria notada. No entanto, se, ao invés
de 4 kg, a família tivesse feito um estoque de 200 kg, após 10 meias-vidas, ainda restaria uma quantidade
considerável de açúcar.
Se o racionamento fosse de sal, a meia-vida do sal seria maior, por que a quantidade de sal que se usa na
cozinha é muito menor do que a de açúcar. De fato, leva-se muito mais tempo para gastar 4 kg de sal do que
4kg de açúcar, para uma mesma quantidade de pessoas (consumidores)
Exemplo Pratico
Vejamos o caso do iodo-131, utilizado em Medicina Nuclear para exames de tireóide,
que possui a meia-vida de oito dias. Isso significa que, decorridos 8 dias, atividade ingerida
pelo paciente será reduzida à metade. Passados mais 8 dias, cairá à metade desse
valor, ou seja, ¼ da atividade inicial e assim sucessivamente. Após 80 dias (10 meiasvidas),
atingirá um valor cerca de 1000 vezes menor.
Entretanto, se for necessário aplicar-se uma quantidade maior de iodo-131 no paciente,
não se poderia esperar por 10 meias-vidas (80 dias), para que a atividade na tireóide
tivesse um valor desprezível. Isso inviabilizaria os diagnósticos que utilizam material
radioativo, já que o paciente seria uma fonte radioativa ambulante e não poderia ficar
confinado durante todo esse período.
Para felicidade nossa, o organismo humano elimina rápida e naturalmente, via fezes,
urina e suor, muitas das substâncias ingeridas. Dessa forma, após algumas horas, o
paciente poderá ir para casa, sem causar problemas para si e para seus familiares.
Assim, ele fica liberado mas o iodo-131 continua seu decaimento normal na urina
armazenada no depósito de rejeito hospitalar, até que possa ser liberado para o esgoto
comum.
O LIXO ATÔMICO
Os materiais radioativos produzidos em Instalações Nucleares (Reatores Nucleares, Usinas
de Beneficiamento de Minério de Urânio e Tório, Unidades do Ciclo do Combustível Nuclear),
Laboratórios e Hospitais, nas formas sólida, líquida ou gasosa, que não têm utilidade, não
podem ser simplesmente “jogados fora” ou “no lixo”, por causa das radiações que emitem.
Esses materiais, que não são utilizados em virtude dos riscos que apresentam, são
chamados de Rejeitos Radioativos.
de Beneficiamento de Minério de Urânio e Tório, Unidades do Ciclo do Combustível Nuclear),
Laboratórios e Hospitais, nas formas sólida, líquida ou gasosa, que não têm utilidade, não
podem ser simplesmente “jogados fora” ou “no lixo”, por causa das radiações que emitem.
Esses materiais, que não são utilizados em virtude dos riscos que apresentam, são
chamados de Rejeitos Radioativos.
Na realidade, a expressão “lixo atômico” é um pleonasmo, porque qualquer lixo é formado
por átomos e, portanto, é atômico. Ele passa a ter essa denominação popular, quando é
radioativo.



No comments:
Post a Comment